
Коррозия
Можем ли мы предотвратить ее?
Джон Коттерил рассказывает о причинах коррозии и методах борьбы с ней
С проблемой коррозии металлов на яхте встречается каждый из нас. Несмотря на героические попытки остановит ее, коррозия молчаливо съедает металлические детали вашей лодки, пока не остается другой альтернативы, как заменить их. Понимание процесса, однако, является первым шагом к предотвращению его. Фотография вверху показывает деталь, принесенную в нашу мастерскую – и это не самый «тяжелый» случай жестокости моря по отношению к металлу, что мне приходилось видеть. Морской воздух также может быть беспощаден.
Тонкий слой атмосферы – около 5-7 метров над поверхностью моря – насыщен солью, которая оседает на коже, одежде, и на всем, что есть на лодке. Эта соль значительно агрессивнее, чем само море, поскольку гигроскопична, и впитывает влагу из воздуха, превращаясь в концентрированный солевой раствор. Попытки смыть соль с яхты морской водой слегка уменьшают концентрацию, но только проливной дождь или тщательное мытье пресной водой со щеткой помогают избавиться от нее. В то время, как пресную воду можно считать хорошим диэлектриком, морская вода обладает весьма низким электрическим сопротивлением и замечательно проводит электрический ток, являясь, таким образом, электролитом. Теперь, если два разных металла, электрически соединенных, окружить электролитом, мы получим гальванический элемент – больше известный как батарейка. Сапог сэйлдрайва (на фото вверху) имел бронзовый складной винт, и защитный анодный протектор, который был полностью съеден. После этого, сапог растворился очень быстро. Между тем, бронзовая втулка осталась нетронутой. Почему так произошло?
Каждый металл занимает определенное место в таблице электрических потенциалов (Рис.1)
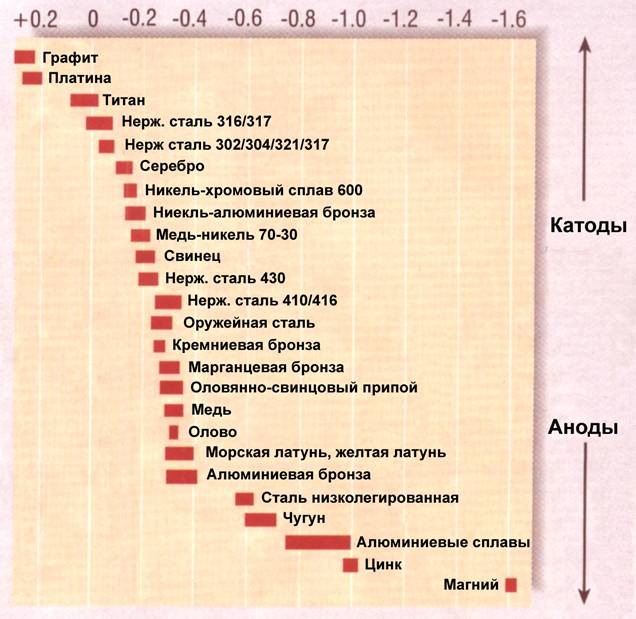
Рис.1. Таблица электрических потенциалов
Самые верхние позиции в таблице принадлежат графиту и платине, которые будут электрически положительными по отношению ко всем остальным металлам. Опускаясь вниз по таблице, где металлы становятся все более электрически отрицательными, нам встречаются: титан, серебро, никель, бронзы, медь, олово, латунь, алюминий, мягкая сталь, цинк, и, наконец, магний. Металлы наверху таблицы называются «катоды», а те, что внизу – «аноды».
Как только пара разных металлов образует гальванический элемент, один из них, находящийся в таблице выше, становится катодом, а другой – анодом. Именно анод и начинает корродировать, отдавая свой металл в электролит. Этот процесс называется «гальваническая коррозия» (Рис.2)
В случае с сапогом сэйлдрайва, алюминиевая «нога» является анодом по отношению к бронзовому винту – катоду, и в электролите морской воды будет разрушаться. Чтобы предотвратить его разрушение, катоду (бронзовому винту) нужно предложить на съедение другой, еще более «анодистый» металл, находящийся в таблице ниже алюминия. Здесь и выходит на арену цинк. Цинковый протектор, размещенный поблизости к винту и являясь более электрически отрицательным, корродирует первым, тем самым защищая алюминиевый сапог. Естественно, как только цинковый протектор скорродирукт полностью, наступит время алюминия пойти его путем.
Скрытые ресурсы гальванической коррозии
Теперь нам легко понятны другие примеры гальванической коррозии – нержавеющий болт, проходящий сквозь алюминиевый стакан леерной стойки, нержавеющие оковки на алюминиевой мачте и т.д. Но менее очевидны гальванические пары, существующие в сплавах металлов. Сплав – это смесь металлов – латунь, например. Она состоит из меди и цинка и цинк будет корродировать быстро, если латунь поместить в электролит. В этом случае цинк будет покидать латунь, где остается только медь, которая будет крошиться в порошок. По этой причине латунь нельзя использовать в яхтах – латунные фитинги в корпусе и входные клапана должны быть исключены.
Другой пример – необрастающая краска на основе меди может служить причиной коррозии металла алюминиевого сапога сэйлдрайава или железного киля. Используйте таблицу электрических потенциалов металлов, чтобы избежать проблем с гальванической коррозией.
Что такое электролитическая коррозия?
Как мы узнали выше, гальваническая коррозия происходит между двумя разными металлами, помещенными в электролит, образуя гальванический элемент. С другой стороны, электролитическая коррозия – это результат принудительного протекания электрического тока через электролит к любому из двух металлов. И они не обязательно должны быть разными. Причиной тока служит внешний источник питания, и ток в электролите течет от анода (+) к катоду (-). Как и в предыдущем случае, анод будет разрушаться. Но в этом случае процесс более быстрый и зависит от силы тока. (Рис.2.)
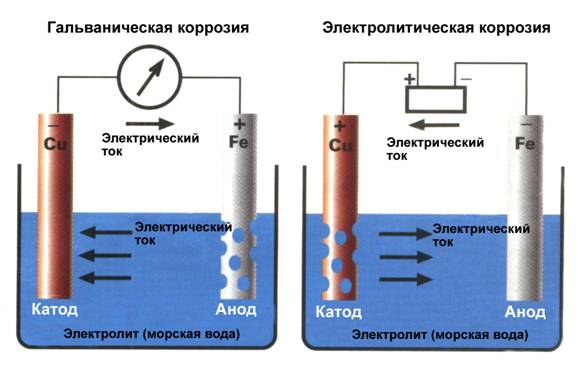
Рис.2 Гальваническая и электролитическая коррозия
Как то мне показали сифонный клапан, помещенный в деревянную коробку рядом с отключателем положительной клеммы аккумулятора. Протекающая из дефектного клапана соленая вода проложила путь из мокрого дерева коробки к положительной клемме 12 V аккумулятора. Отсюда, с « +», по этому пути, через корпус клапана и по системе охлаждения и теплообменник, ток пошел на корпус двигателя и к «-« батареи. Латунный патрубок скорродировал очень быстро, но теплообменник не пострадал.
Блуждающие электрические токи, подобные этому, не редкость на яхтах. Они появляются от мокрых проводов и плохих соединений в контактах, и стремятся найти себе новый путь через мокрую древесину или стеклопластик. Они могут утекать от двигателя к системе зазаемления или распространиться на корпус, когда вы поставляете электроэнергию с берега. В таких случаях, учитывая большую силу потребляемого тока, металлический корпус, становясь анодом, корродирует чрезвычайно активно. Пристальное внимание состоянию проводов и соединений защитит вашу лодку от электролитической коррозии.
Болезнь двигателя
Охлаждение двигателя забортной водой – вот что убивает ваш двигатель. Соленая вода в процессе гальванической коррозии забирает железо из чугунной отливки блока цилиндров и головки блока, оставляя там мягкий графит, который легко соскоблить перочинным ножом. Первой жертвой становятся острые края. Поэтому морские двигатели проектируются с учетом этого явления с массивными блоками, и способны долго противостоять этому процессу. Но конвертация для морских условий автомобильных двигателей, приспособленных к охлаждению пресной водой или антифризами, выдвигает эту проблему на первый план. Выходом из ситуации служит применение водо-водяных холодильников, но, к сожалению, и они требуют замены через 5-7 лет. Здесь имеется несколько проблем. Обычная коррозия чугуна значительно ускоряется при повышении температуры, к тому же, после остановки двигателя, вода остается в системе, продолжая процесс. Любая влага в выхлопной системе также усугубляет ситуацию.
Отдельно от коррозии, любые изогнутые под углом трубы подвержены эрозии вследствие трения горячей воды, текущей с большой скоростью, о стенки трубы на резких поворотах. Если труба сделана из меди, этот процесс может стереть слой оксидов на ее внутренней поверхности. Медь – это один из тех металлов, которые быстро образуют на своей поверхности слой оксидов, защищающих от коррозии. Свинец, алюминий, нержавеющая сталь защищают себя подобным образом. Соленая вода, идущая по трубам, содержит в себе достаточное количество кислорода для образования оксидной пленки на поверхности трубы, но, не успевая образоваться, она тут же смывается этим же потоком. Охлаждающие трубы двигателя обычно гнут в холодном состоянии, и относительно несложно образовать колено или фланец – но за такую возможность приходится платить свою цену. Подобно всем металлам, медь имеет мелкозернистую структуру, и когда металл изгибают или скручивают, его структура нарушается, и в этих местах коррозия прогрессирует. Эти явления должны быть достаточными основаниями для владельца, чтобы закрывать входной клапан системы охлаждения, когда он покидает лодку.
Проблемы гребного вала
Для образования защитной оксидной пленки на поверхности нержавеющей стали, должен быть обеспечен постоянный приток кислорода. В противном случае развивается «точечная» коррозия. Это может иметь место в таких местах и соединениях на лодке, где кислород исключен. Одним из таких мест является дейдвудная труба, в которой гребной вал находится в застойной воде, очень бедной на кислород. На фотографии показан гребной вал, подверженный серьезной точечной коррозии вследствие отсутствия кислорода в дейдвудной трубе.

Нержавеющая сталь может также страдать от процесса, называемого « коррозия сварного шва». Вы неоднократно могли видеть полированные нержавеющие детали на яхтах, покрытые ржавчиной в районе сварного шва. В момент сварки, под воздействием высокой температуры, легирующий металл хром удаляется из расплавленного сварного шва, оставляя там железо, которое и ржавеет.
Из “Boat Owner” by John Cotterill
Перевод С.Свистула |




